Farmacéutica Gilead fija en unos 2.000 euros la primera terapia aprobada para la covid-19
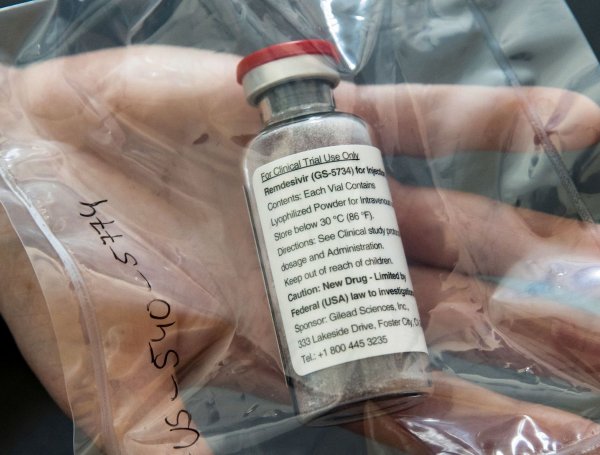
La terapia con remdesivir, el primer fármaco aprobado para tratar casos graves de covid-19, costará 2.340 dólares -2.076 euros- por paciente en los países desarrollados. La farmacéutica Gilead, fabricante del antiviral que ha testado su eficacia en casos de neumonía por coronavirus, ha fijado en 390 dólares (unos 347 euros) la dosis de este medicamento. El fármaco, que ya ha sido aprobado en Estados Unidos y recientemente avalado por la Agencia Europea del Medicamento (EMA), se puede administrar entre cinco y 10 días a los pacientes adultos y adolescentes a partir de 12 años con neumonía que requieran oxígeno suplementario. La duración habitual de la terapia, señala la compañía, suele ser de seis viales en cinco días.
“Somos conscientes de la gran responsabilidad de precios que conlleva el remdesivir y la necesidad de ser transparentes en nuestra decisión. En circunstancias normales, valoraríamos un medicamento de acuerdo con el valor que proporciona. Hemos decidido cotizar remdesivir muy por debajo de este valor. Para garantizar un acceso amplio y equitativo en un momento de necesidad mundial urgente, hemos establecido un precio para los Gobiernos de los países desarrollados de 390 dólares por vial”, ha explicado el consejero delegado de Gilead, Daniel O’Day en una carta abierta publicada por la compañía.
Según un estudio publicado en la revista médica New England Journal of Medicine (NEJM) con más de un millar de pacientes y financiado por el Instituto Nacional de Enfermedades Infecciosas de Estados Unidos (Niaid), los enfermos que tomaban remdesivir se recuperaban una media de cuatro días antes que el resto de pacientes. Con la terapia antiviral se reducía un 31% el tiempo de recuperación (de 15 días en el grupo placebo a 11 en los pacientes tratados con remdesivir) y también ligeramente la mortalidad (era del 12% en el brazo placebo al 8% en el brazo medicado con el antiviral), aunque esto no era estadísticamente significativo.
“Tomando el ejemplo de los Estados Unidos, el alta hospitalaria anterior resultaría en ahorros hospitalarios de aproximadamente 12.000 por paciente”, ha ejemplificado O’Day en la misiva. La FDA, que funciona como la EMA en Estados Unidos, ya había aprobado a principios de mayo por la vía de emergencia el uso del remdesivir para tratar la covid-19. La EMA, por su parte, recomendó la semana pasada dar luz verde a su comercialización, aunque la decisión final la tomará la Comisión Europea esta semana. Ambas agencias reguladoras recomendaban administrar 200 miligramos (dos viales) el primer día y 100 miligramos los siguientes cuatro días de tratamiento. Esto significa, según el precio estipulado por Gilead, 2.340 dólares por tratamiento, aunque las autoridades permiten alargar la terapia durante un total de nueve días.
Al fijar un precio común, la farmacéutica se evita las negociaciones país a país. “Parte de la intención detrás de nuestra decisión fue eliminar la necesidad de negociaciones país por país. Bajamos el precio a un nivel que sea asequible para los países desarrollados con el poder adquisitivo más bajo. Este precio se ofrecerá a todos los Gobiernos de los países desarrollados de todo el mundo donde remdesivir está aprobado o autorizado para su uso”, ha apuntado el consejero delegado de la compañía.
Los expertos consultados señalan lo excepcional de la medida, pero también guardan sus reticencias respecto a este fármaco y todo lo que gira a su alrededor. “Como estrategia de marketing y venta masiva me parece excelente. Pero eso no aumenta su nivel de eficacia, aunque lo hace más asequible. Hay que esperar los estudios que puedan demostrar una mejora clara y significativa de la mortalidad y en qué tipo de pacientes. Hasta entonces para España con la situación que tenemos ahora no es para nada una prioridad”, zanja Benito Almirante, jefe de Enfermedades Infecciosas del Hospital Vall d’Hebron de Barcelona.
En la misma línea que Almirante se posiciona el farmacólogo Xavier Carné, exmiembro de la Comisión Nacional de Evaluación de Medicamentos: “Creo que la situación no tiene precedentes. Por ahora es el único fármaco antiviral efectivo para la covid-19 y, por tanto, tienen monopolio, pero si aparecen competidores, todo cambiará”.